Клинические испытания вакцины от коронавируса центра «Вектор» завершены, сообщила глава Роспотребнадзора Анна Попова. Она также сообщила, что продолжаются клинические испытания вакцины от коронавируса института Чумакова.
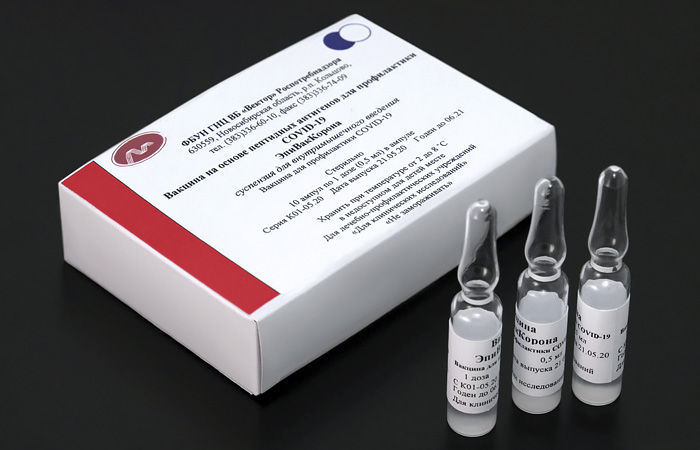
«И это все вакцины на разных платформах. И это очень хорошо, потому что это вакцины с несколько разным способом воздействия на организм, безусловно, с разной реактогенностью они будут. И главное, они будут для производства занимать совершенно разные технологические площадки производственные. Мы не будем ограничены в количестве, которое можем произвести», - добавила Попова.
Попова отметила в интервью, что критика российских вакцин от коронавируса на Западе не имеет научного обоснования.
«Российские вакцины абсолютно не заслуживают никакой критики, кроме определенно обусловленной, но практического и научного под этим абсолютно нет ничего», - сказал она.
По ее словам, школа вакцинологии в РФ, в Советском Союзе исторически была очень сильная, все отечественные вакцины создавались и создаются по всем правилам и всем канонам.
«Вакцины все разные, и это очень хорошо», - сказала Попова.
Первой российской вакциной от коронавируса стала вакцина «Спутник V», разработанная Институтом имени Гамалеи Минздрава РФ. Это векторная вакцина на основе безопасного аденовируса, который используется в качестве контейнера для доставки отдельных белков «короны» коронавируса в организм.
Вторую вакцину разработал центр «Вектор» Роспотребнадзора. Регистрация вакцины «Вектора» «ЭпиВакКорона» ожидается до 15 октября.
Пострегистрационные клинические исследования вакцины от коронавируса "ЭпиВакКорона" планируется начать в сибирском регионе на пяти тысячах добровольцев, отдельное исследование планируется провести на 150 людях старше 60 лет. Далее будут проведены широкомасштабные плацебо-контролируемые исследования, которые начнутся в сибирском регионе на 5000 добровольцев в возрасте от 18 до 60 лет и далее будут продолжены в регионах.
Вакцина "ЭпиВакКорона" состоит из двух частей, первая и вторая вакцинации проводятся с интервалом в 21 день. "Протокол третьего (пострегистрационного) этапа клинических исследований находится в разработке и согласовании",- сообщили в институте.