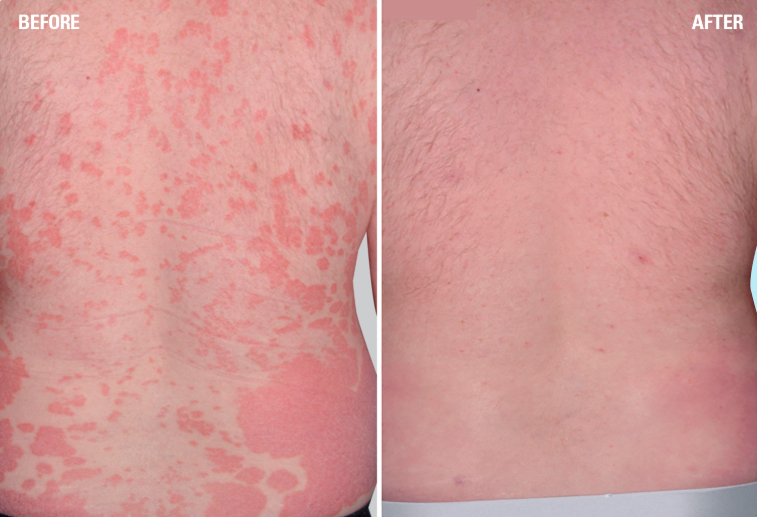
Глобальная биофармацевтическая компания AbbVie объявила о новых последних результатах прямого сравнительного исследования фазы 3b, демонстрирующих более высокие показатели очищения кожи препаратом СКАЙРИЗИ/SKYRIZITM (рисанкизумаб) на 52 неделе терапии по сравнению с препаратом КОЗЭНТИКС® (секукинумаб).
В частности, 66 % пациентов с псориазом, получающие препарат СКАЙРИЗИ/SKYRIZITM, на 52 неделе достигли полного очищения кожи — 100 % очищение кожи по индексу тяжести и распространенности псориаза (PASI 100) — по сравнению с 40 % пациентов, получающих препарат КОЗЭНТИКС® (p<0,001) 1.
- Новые результаты прямого сравнительного открытого исследования IMMerge фазы 3b показывают, что препарат СКАЙРИЗИ/SKYRIZI™ превосходит по эффективности препарат Козэнтикс® (секукинумаб) на 52 неделе после начала лечения, причем у 66 % пациентов, получавших препарат СКАЙРИЗИ/SKYRIZI™, удалось добиться полного очищения кожи (по индексу PASI 100) по сравнению с 40 % пациентов, получавших препарат Козэнтикс® (секукинумаб)[1]
- Новых сигналов по безопасности на фоне применения препарата СКАЙРИЗИ/SKYRIZI™ в течение 52 недель не наблюдалось1
Результаты нового прямого сравнительного открытого исследования IMMerge фазы 3b были представлены на онлайн-конференции Американской академии дерматологии (AAD). В январе этого года компания AbbVie объявила о скором обнародовании последних результатов этого исследования.
«Я был свидетелем того, как достижение и поддержание полностью чистой кожи оказывало чрезвычайно положительное влияние на качество жизни моих пациентов с псориазом, — сообщил главный исследователь Ричард Б. Уоррен (Richard B. Warren), профессор, M.D., Ph.D., лектор и почетный дерматолог-консультант дерматологического отделения Salford Royal NHS Foundation Hospital Манчестерского университета. — Эти новые данные имеют решающее значение, поскольку они подчеркивают, что длительное, полное очищение кожи — это достижимая цель лечения людей, страдающих псориазом».
Дополнительные результаты продемонстрировали, что значительная доля пациентов, получавших препарат СКАЙРИЗИ/SKYRIZITM, достигла на 52 неделе лечения показателя чистой или почти чистой кожи (sPGA 0/1) по сравнению с пациентами, получавшими препарат КОЗЭНТИКС® (88 % против 58 % соответственно, р<0,001) 1.
Препарат СКАЙРИЗИ/SKYRIZITM достиг первичной конечной точки PASI 90 не меньшей эффективности (non-inferiority) на 16 неделе и превосходства (superiority) на 52 неделе в сравнении с препаратом КОЗЭНТИКС®1. На 16 неделе 74 % пациентов, получавших препарат СКАЙРИЗИ/SKYRIZITM, достигли PASI 90 в сравнении с 66 % пациентов, получавших препарат КОЗЭНТИКС®1. На 52 неделе 87 % пациентов, получавших препарат СКАЙРИЗИ/SKYRIZITM, достигли PASI 90 по сравнению с 57 % пациентов, получавших препарат КОЗЭНТИКС® (р<0,001) 1.
Имеющиеся в настоящее время данные показали, что профиль безопасности препарата СКАЙРИЗИ/SKYRIZITM соответствует профилю безопасности предыдущих исследований, при этом новых сигналов по безопасности в течение 52 недель не зарегистрировано1-4. Частота нежелательных явлений (НЯ) при применении препаратов СКАЙРИЗИ/SKYRIZITM и КОЗЭНТИКС® была сопоставима1. Наиболее частыми НЯ были назофарингит, инфекции верхних дыхательных путей, головная боль, артралгия и диарея1. Частота серьезных НЯ в группе пациентов, получавших препарат СКАЙРИЗИ/SKYRIZITM, составляла 5,5 %, а в группе пациентов, получавших препарат КОЗЭНТИКС®, — 3,7 %1. Частота НЯ, приведших к прекращению исследуемого препарата, составила 1,2 % для группы пациентов, получавших препарат СКАЙРИЗИ/SKYRIZITM, и 4,9 % — для группы пациентов, получавших препарат КОЗЭНТИКС®1. Летальных исходов ни в одной из групп отмечено не было1.
Препарат СКАЙРИЗИ/SKYRIZITM разработан в рамках сотрудничества между компаниями Boehringer Ingelheim и AbbVie. Клинической разработкой препарата СКАЙРИЗИ/SKYRIZITM и его международным коммерческим продвижением занимается компания AbbVie.
Об исследовании IMMerge фаза 3b1,5
IMMerge — это многоцентровое рандомизированное, открытое (обе группы), заслеплённое по эффективности для врача-исследователя исследование фазы 3b с активным препаратом сравнения по оценке безопасности и эффективности применения препарата СКАЙРИЗИ/SKYRIZITM по сравнению с препаратом КОЗЭНТИКС® у взрослых пациентов с бляшечным псориазом средней и тяжелой степени тяжести. Пациенты были рандомизированы в соотношении 1:1, первой группе (n=164) вводили препарат СКАЙРИЗИ/SKYRIZITM (в дозе 150 мг) в виде двух подкожных инъекций по 75 мг на неделе 0, 4, затем каждые 12 недель; второй группе (n=163) вводили препарат КОЗЭНТИКС® (в дозе 300 мг) в виде двух подкожных инъекций по 150 мг исходно, затем — на 1, 2, 3 и 4 неделе, далее — каждые четыре недели. В исследовании были определены две первичные конечные точки (не меньшей эффективности (non-inferiority) на 16 неделе по PASI 90, а также превосходство (superiority) на 52 неделе по PASI 90) и три ранжированные вторичные конечные точки (PASI 100 на 52 неделе, sPGA 0/1 на 52 неделе и PASI 75 на 52 неделе). Оценку безопасности проводили у всех пациентов.
Более подробную информацию о данном исследовании можно найти на сайте www.clinicaltrials.gov (NCT03478787).
О применении препарата СКАЙРИЗИ/SKYRIZITM (рисанкизумаб) в США6
Препарат СКАЙРИЗИ/SKYRIZITM показан для лечения бляшечного псориаза средней и тяжёлой степени тяжести у взрослых пациентов, являющихся кандидатами на проведение системной терапии или фототерапии. На момент подготовки пресс-релиза препарат СКАЙРИЗИ/SKYRIZITM не зарегистрирован для медицинского применения в Российской Федерации.
Важная информация по безопасности
Инфекции
Препарат СКАЙРИЗИ/SKYRIZITM может увеличивать риск развития инфекционных заболеваний. Не следует начинать терапию препаратом СКАЙРИЗИ/SKYRIZITM у пациентов с клинически значимым инфекционным заболеванием в активной стадии до тех пор, пока оно не будет купировано или не будет получено адекватное лечение.
Для пациентов с хронической или рецидивирующей инфекцией в анамнезе следует рассмотреть все возможные риски и преимущества лечения перед назначением препарата СКАЙРИЗИ/SKYRIZITM. Следует предупредить пациентов о необходимости обращения за медицинской помощью в случае появления признаков или симптомов клинически значимой инфекции. Если у пациента развивается инфекционный процесс или он не отвечает на стандартную терапию, необходимо осуществлять постоянный контроль состояния и прервать лечение препаратом СКАЙРИЗИ/SKYRIZITM до полного исчезновения симптомов инфекции.
Исключение туберкулеза (ТБ) до начала лечения
Перед началом лечения препаратом СКАЙРИЗИ/SKYRIZITM необходимо оценить наличие туберкулезной инфекции и рассмотреть возможность лечения пациентов с латентной или активной формой туберкулеза, для которых не может быть определен адекватный курс терапии. Необходимо осуществлять постоянное наблюдение за пациентами на предмет появления признаков и симптомов активной формы туберкулеза во время и после лечения препаратом СКАЙРИЗИ/SKYRIZITM. Не следует назначать препарат СКАЙРИЗИ/SKYRIZITM пациентам с активной формой туберкулеза.
Вакцинация
Перед назначением препарата СКАЙРИЗИ/SKYRIZITM необходимо убедиться в наличии соответствующих возрасту прививок согласно действующим рекомендациям по вакцинации. Следует избегать использования живых вакцин у пациентов, получающих лечение препаратом СКАЙРИЗИ/SKYRIZITM.
Нежелательные реакции
Наиболее распространенными (≥1 %) нежелательными реакциями, связанными с применением препарата СКАЙРИЗИ/SKYRIZITM, являются инфекции верхних дыхательных путей, головная боль, утомляемость, воспалительные реакции в месте инъекции и грибковые заболевания кожи.
Это не полная информация по безопасности. Более подробную информацию о препарате можно получить на сайте SKYRIZI.com. В разных странах инструкция по применению препарата различается; для получения полной информации обратитесь к инструкции по применению для конкретной страны.
[1] Warren, R.B., et al.. Risankizumab Versus Secukinumab in Patients with Moderate-to-Severe Plaque Psoriasis: A Phase 3 Trial. Presentation # TBD. American Academy of Dermatology Annual Meeting. 2020.
2 Gordon K, et al. Efficacy and safety of risankizumab in moderate-to-severe plaque psoriasis (UltIMMa-1 and UltIMMa-2): results from two double-blind, randomised, placebo-controlled and ustekinumab-controlled phase 3 trials. The Lancet. 2018 Aug 25; 392(10148):650-661.
3 Reich, K., et al. Risankizumab compared with adalimumab in patients with moderate-to-severe plaque psoriasis (IMMvent): a randomised, double-blind, active-comparator-controlled phase 3 trial. Lancet. 2019 Aug 17;394(10198):576-586. doi: 10.1016/S0140-6736(19)30952-3.
4 Blauvelt, A., et al. Efficacy and Safety of Continuous Q12W Risankizumab Versus Treatment Withdrawal: 2-Year Double-Blinded Results from the Phase 3 IMMhance Trial. Poster #478. 24th World Congress of Dermatology. 2019.
5 Risankizumab Versus Secukinumab for Subjects With Moderate to Severe Plaque Psoriasis. ClinicalTrials.gov. 2019. Available at: https://clinicaltrials.gov/ct2/show/NCT03478787.
6 SKYRIZI (risankizumab) [Package Insert]. North Chicago, Ill.: AbbVie Inc.